Autor: M.C.F. Daniel De la Barrera Escamilla
País: México
Desde una aplicación forense, este perfil genético puede utilizarse para dos aplicaciones fundamentales:
la determinación biológica de parentesco o la identificación humana en investigaciones judiciales. La primera de ellas, establece que la constitución genética de un individuo es resultado de la herencia genética obtenida de los progenitores, por lo que la perfilación genética nos ayuda a establecer cuál de esos dos marcadores tiene un origen paterno y el otro materno. En el caso de la identificación, la total correspondencia del perfil genético de un sospechoso con el perfil genético de un indicio recuperado en el lugar de los hechos deber ser total para cada marcador genético analizado y comparado.
Debido a que el ADN se puede encontrar prácticamente en cualquier sustrato biológico que contenga células (excepto los eritrocitos); los procedimientos en el laboratorio han cambiado de tal forma que es posible realizar la obtención de un perfil genético de identificación de elementos encontrados en el lugar de los hechos tales como colillas de cigarros, gomas de mascar, gotas pequeñas de sangre, cabellos, rastros de semen, manchas de saliva, etc. (Figura No. 4)
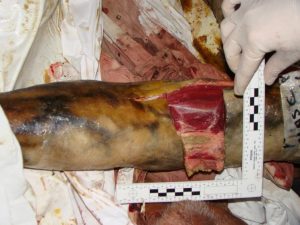
Figura No. 4: “Tejido muscular en estado de putrefacción donde se puede localizar material genético”
Son principalmente cuatro fases las que se siguen en el laboratorio de Genética Forense para la obtención del perfil genético, aunque es menester resaltar que un buen trabajo en el laboratorio depende en su mayor parte de un correcto trabajo que se haga de criminalística de campo, es decir, se tienen que aplicar correctamente los métodos de colecta y resguardo de todas y cada una de las muestras biológicas recolectadas en el lugar, de manera que se conserven la mayor cantidad de células hasta su llegada al laboratorio.
La primera fase analística en el laboratorio, una vez que se han recibido en cadena de custodia las muestras, es la valoración (Figura No. 5) Aún y cuando en la actualidad se cuenten con herramientas técnicas que permiten el procesamiento adecuado de las muestras, los indicios biológicos trabajados en el ámbito forense suelen ser las más complicadas, ya que se presentan en condiciones contrarias, no conservadas, afectadas por inclemencias del tiempo, contaminación bacteriana y otros que demeritan la calidad de la célula y por lo tanto degradan el material genético. Por lo que una valoración en el laboratorio permitirá conocer el estado de las células, su cantidad, la calidad del ADN y otras características.

Figura No. 5: “Valoración inicial de los indicios de interés forense”
Una vez que se ha valorado la muestra, se procede al segundo paso denominado extracción en microcantidades; este proceso permite obtener el ADN en suspensión y eliminar los componente celulares como membranas y organelos que impiden el análisis de la secuencia. Dada la naturaleza de cada muestra se tienen a disposición diversos sistemas manuales y automatizados que permiten la extracción del material genético, que van desde las más clásicas como la extracción orgánica con fenol, cloroformo, alcohol isoamílico hasta sistemas con resinas magnéticas o resinas quelantes que permiten obtener un gran porcentaje de eficiencia de extracción. Dichos sistemas con la integración en la solución de extracción de buffers de lisis o de extracción y proteinasas además de sistemas automatizados, permiten manipular varias muestras en un mismo proceso y reducir considerablemente el tiempo en el laboratorio. Posteriormente a la extracción, la cuantificación del ADN humano es el paso siguiente, el cual tiene por objeto determinar la cantidad que existe en suspensión de la extracción en el paso anterior; este punto es crítico ya que la amplificación por PCR requiere de una medida aproximada de la cantidad de ADN que será utilizada en la mezcla de reacción. Existen diversos sistemas para lograr la cuantificación, como el extinto Quantiblot ® que mediante una sistema de blot permitía cuantificar por colorimetría la cantidad de ADN presente al hacer reaccionar la muestra con una sonda especial humana marcada; aunque el sistema que actualmente se utiliza es mediante PCR en tiempo real con el sistema Aluquant ®.
Muchos de los vestigios biológicos de interés forense (Figura No. 6) presentan cantidades muy pequeñas de ADN o un ADN muy deteriorado, por lo que no son susceptibles de ser analizados mediante análisis de RFLPs. Para estos casos resulta de gran utilidad el uso de la técnica de amplificación de ADN mediante la reacción en cadena de la polimerasa o PCR (Polymerase Chain Reaction), descubierta por Kary Mullis en 1985. Esta técnica ha supuesto una auténtica revolución en el mundo de la Biología Molecular, lo que le valió a su inventor el premio Nobel en 1993. La introducción de la PCR en Genética Forense ha hecho posible el análisis de una gran variedad de muestras cuyo estudio resultaba imposible mediante las técnicas convencionales.
Figura No. 6: “Vista preliminar de un indicios procesado y listo para extracción de ADN”
La PCR permite la obtención in vitro de millones de copias de un fragmento de ADN específico a partir de una cantidad ínfima de ADN (de hasta picogramos) mediante una reacción enzimática cíclica. Los componentes básicos en un mezcla de reacción de PCR (Figura no. 7) son: el ADN molde extraído a partir de la muestra biológica, un par de oligonucleótidos o cebadores (pequeños fragmentos de ADN de cadena simple de secuencia complementaria a las regiones que flanquean al segmento de ADN de interés) en ese caso los marcadores genéticos o STR´s; que mediante su unión específica al ADN molde permiten iniciar la reacción, la polimerasa (enzima que cataliza la reacción), nucleótidos (que servirán de sustrato con los que sintetizar las nuevas cadenas de ADN), incluso esta última obtenida ya mediante procesos de ingeniería genética, lo cual abarata el costo del proceso y además del tampón y las sales necesarios para el óptimo funcionamiento de la enzima.(10)

Figura No. 7: “Equipo de termociclador utilizado para realizar la PCR”
La PCR se fundamenta en algunas de las propiedades del ADN ya mencionadas; Un proceso estándar de PCR implica la repetición de un número determinado de ciclos, cada uno de los cuales consta de tres pasos:
a) Desnaturalización: mediante elevación de la temperatura a 90-95 º C las dos cadenas de la doble hélice de ADN molde se separan, quedando en forma de cadena simple.
b) Hibridación: al disminuir la temperatura a 50-65 ºC, los cebadores se unen al ADN molde justo en el lugar de sus secuencias complementarias (su pequeño tamaño favorece esta unión frente a la posibilidad de renaturalización o unión de la cadena complementaria de ADN molde).
c) Extensión: el calentamiento a 72 °C (temperatura óptima de funcionamiento de la polimerasa), permite la extensión de la cadena de ADN a partir de los cebadores mediante la adición sucesiva de nucleótidos tomando como referencia la secuencia del ADN molde. Estos tres pasos se repiten cíclicamente entre 25 y 35 veces, de forma que el proceso total de la reacción dura aproximadamente 3 horas.
Con las metodologías actuales se pueden realizar amplificaciones múltiples, mediante sistemas que contienen 13, 16 o más marcadores genéticos y que pueden generarse los ciclos necesarios para obtener los perfiles genéticos de varias muestras al mismo tiempo. Ello ha supuesto un gran esfuerzo conjunto por parte de la comunidad científica genético-forense y de las casas comerciales para el desarrollo, puesta a punto y validación de kits de reacción de PCR optimizados para obtener el máximo rendimiento de la mínima cantidad de ADN, lo que se ha traducido en una disminución importante en la cantidad de ADN molde requerida, factor muy importante en muestras mínimas.
Las implicaciones metodologías de está técnica han sido valoradas por muchos laboratorios de Genética Forense a nivel nacional e internacional y de igual forma, como se comentó, el trabajo en campo; el trabajo en laboratorio debe de cumplir con cierta normatividad que asegure que el proceso desde la extracción hasta la obtención del perfil genético se realiza bajo las más estrictas normas de calidad y donde se tenga la certeza de que procesos de contaminación cruzada no se van a presentar, delimitando bien los espacios físicos de extracción, amplificación y secuenciación dentro de las instalaciones. En el laboratorio de ADN forense, a menudo se trata con vestigios biológicos que están lejos de ser la muestra ideal, tanto en lo que se refiere a su cantidad como a su calidad. No debemos olvidar que, aunque la PCR ha supuesto una revolución en biología forense, presenta una serie de limitaciones que a veces son muy difíciles de salvar. Estas limitaciones se refieren principalmente a las posibilidades de: a) degradación, propia de muestras antiguas, putrefactas, procedentes de cadáveres en descomposición o aquellas sometidas a condiciones ambientales adversas y en las que el ADN se encuentra muy fragmentado, lo cual dificulta o impide la obtención de fragmentos de ADN del tamaño esperado; b) inhibición de la reacción de PCR por la presencia de determinadas sustancias como tintes textiles, altas concentraciones de melanina o hemoglobina en el extracto de ADN u otras, que bloquean a la polimerasa impidiendo la amplificación; c) modificación del ADN, consistente en la existencia de enlaces covalentes intra o intercatenarios, depurinización o roturas que hacen al ADN no susceptible de ser amplificado y que pueden deberse a la conservación de cada muestra.
El cuarto y último paso en este procedimiento es la secuenciación; dicho procedimiento consiste en la lectura de las muestras amplificadas en el proceso de PCR para la obtención de los perfiles. Dicho proceso puede realizarse de dos formas básicas, una secuenciación manual mediante geles de poliacrilamida y una secuenciación automatizada mediante un secuenciador. El primer proceso involucra la separación por carga y pesos moleculares dentro de una matriz de poliacrilamida, para después ser tenidos por nitrato de plata o fluorescencia. La secuenciación automática involucra el marcado con fluorocromos cada base nitrogenada para que puedan ser detectadas las longitudes de onda mediante un lector laser y se transforma a un electroferograma.
Es importante señalar, que la automatización provee de un mejor sistema de trabajo en laboratorios con una gran cantidad de muestras a procesar ya que dependiendo del modelo de secuenciador se pueden trabajar de manera simultánea hasta 96 muestras, reduciendo considerablemente el tiempo de obtención de los perfiles genéticos.
Actualmente existen miles de STRs identificados y se calcula que en el genoma humano existe un STR cada 10 000 pares de bases. Entre los distintos tipos de STRs, los más comunes con fines forenses son aquellos cuyas repeticiones constan de cuatro nucleótidos o cinco. Estos presentan la ventaja, frente a aquellos con unidades de repetición menores (dos o tres nucleótidos), de una mejor resolución entre alelos de tamaño próximo en individuos heterocigotos, así como una reducción en la formación de bandas fantasmas en la PCR. En los criterios a seguir para la selección de STRs con aplicación en identificación humana deben primar los siguientes factores: alto poder de discriminación, alta heterocigosidad, localización en distintos cromosomas para evitar el ligamiento entre marcadores, robustez y reproducibilidad de resultados en reacciones múltiplex, baja tasa de mutación y longitud de alelos en el rango de 90-450 pares de bases.
Para un intercambio y comparación de resultados efectivso entre distintos laboratorios es necesaria la utilización de una batería de marcadores genéticos comunes. Actualmente, los marcadores más extendidos a nivel mundial son los 13 STRs autosómicos integrados en el sistema CODIS (Combined DNA Index System) establecido en 1997 por el FBI para la creación de un banco de datos nacional. La probabilidad de coincidencia al azar entre individuos no relacionados mediante el análisis de los 13 marcadores del CODIS es inferior a uno en un billón; o también el sistema Power Plex 16 ® de Promega Corporation que es utilizada como una base de datos en diferentes países latinoamericanos incluido México, y que permite un poder de discriminación superior a 1 en 2 X 10 17.
CONTINÚA PARTE 3.

Deja una respuesta